Коронавирус
Фибринолитическая терапия рефрактерного острого респираторного дистресс-синдрома COVID-19
17.05.2020Введение
Тромботическая коагулопатия присутствует почти у трех четвертей пациентов с COVID-19, поступивших в отделение интенсивной терапии. Клиническая картина и патоморфологические данные согласуются с тем, что окклюзионные микрососудистые явления являются одним из основных факторов развития дыхательной недостаточности. Многочисленные исследования в области лечения COVID-19 в основном сфокусированы на антицитокиновой, антибактериальной и противовирусной терапии, однако, наблюдается явная нехватка исследований по оценке противотромботической терапии как способа улучшения течения дыхательной недостаточности при COVID-19. В данной статье описаны результаты анализа имеющихся на настоящий момент данных о связи между тромботической коагулопатией и дыхательной недостаточностью в контексте COVID-19, а также представлено научное обоснование для рассмотрения возможности целенаправленного воздействия на процессы коагуляции и фибринолиза с целью улучшения функции дыхания у данных пациентов.
Фибринолиз, ОРДС и возможная роль фибринолитической терапии в лечении пациентов с COVID-19.
Низкий уровень фибринолиза связан с ОРДС [1–5], что актуально и для пациентов, которые находятся с COVID-19 в отделении интенсивной терапии. У таких больных при проведении тромбоэластографии были выявлены более низкие уровни фибринолиза, чем у контрольной группы [6]. Исследования, начавшиеся десятилетия назад, продемонстрировали системные и локальные эффекты нарушения процессов коагуляции при ОРДС [7–11]. ОРДС, независимо от причины, ведет к отложению фибрина в дыхательных путях и появлению микротромбов в сосудистой сети легких [12–14], что также наблюдается у пациентов с COVID-19 [15–17]. В значительной степени дисфункция системы гемостаза обусловлена продукцией тканевых факторов альвеолярными эпителиальными клетками и макрофагами [18], а также высокого уровня ингибитора активатора плазминогена-1 (ИАП-1), который, в свою очередь, продуцируется эндотелиальными клетками или активированными тромбоцитами. В соответствии с этим, увеличенное время действия протромбина, повышенные уровни D-димера и продуктов распада фибрина, наряду с повышенным уровнем фибриногена, были зарегистрированы у тяжелобольных пациентов с COVID-19, особенно в случаях с летальным исходом [18–23].
Аналогичные результаты были обнаружены при сепсисе [24, 25], эндотоксемии [26] и обширном поражении тканей [27], при котором ранняя активация коагуляции и фибринолиз сопровождается в последующем снижением фибринолитической активности и эндотелиальной дисфункцией. Сходная картина наблюдается при первичном поражении вирусной инфекцией эпителиальных клеток дыхательных путей и, в случае COVID-19, с последующим распространением в эндотелиальные клетки, экспрессирующие белок-рецептор вируса, ангиотензинпревращающий фермент-2 (АПФ2) [28], [29]. Кроме того, было показано, что у пациентов с COVID-19 в критическом состоянии часто обнаруживаются признаки гиперкоагуляции при проведении вязкоупругих анализов по сравнению с контрольной группой с сокращенным временем реакции (R-временем), увеличенным углом α, увеличенной максимальной амплитудой и, практически во всех случаях, снижением уровня фибринолиза при тромбоэластографии [6].
В 2001 году Hardaway с соавторами провел небольшое неконтролируемое исследование на людях с тяжелой формой ОРДС, которое показало, что уро / стрептокиназа способствовала значительному улучшению дыхательной функции без случаев кровотечения [30]. Использование тканевого активатора плазминогена (тАП) представляет собой более современный фибринолитический подход с более высокой эффективностью лизиса сгустка. Мета-анализ острого повреждения легких у животных показал, что, по сравнению с группой контроля, тАП улучшает выживаемость, хотя ни одно из исследований не включало ОРДС, вызванный вирусами [31]. В других исследованиях тАП, доставленный через дыхательные пути, улучшал показатели выживаемости и заболеваемости, связанные с острым пластическим бронхитом, при котором происходит свертывание в просвете дыхательных путей [5], [9], [21], [22], [30]–[33]. С целью уменьшения количества фибрина в дыхательных путях использовались как небулайзерное, так и прямое введение тАП в дыхательные пути с помощью бронхоскопии [34]. Применение тАП на животных моделях при тяжелых легочных микрососудистых тромбозах и выраженном фиброзе легких привело к улучшению выживаемости, газообмена дыхательных путей и нормализации pO2 и pCO2 [20], [35]. Тем не менее, все больше свидетельств, что для COVID-19 характерен легочный микрососудистый тромбоз [15–17], который сочетается с нормальной податливостью легких и высокими градиентами альвеолярно-артериального кислорода [36]. Предполагается, что внутрисосудистая доставка может быть оптимальным путем доставки ввиду того, что аэрозольные способы увеличивают риск инфицирования медицинского персонала через вдыхание капель секрета дыхательных путей пациента.
Таким образом тАП может занять свое место в терапии тяжелых форм COVID-19. Важно отметить, что такой подход не является исключительным и может быть использован у пациентов, которых лечили другими экспериментальными агентами, включая блокаторы рецепторов к интерлейкину-6, антибактериальными препаратами и противовирусными средствами.
Практические рекомендации к фибринолитической терапии при лечении ОРДС, вызванного COVID-19
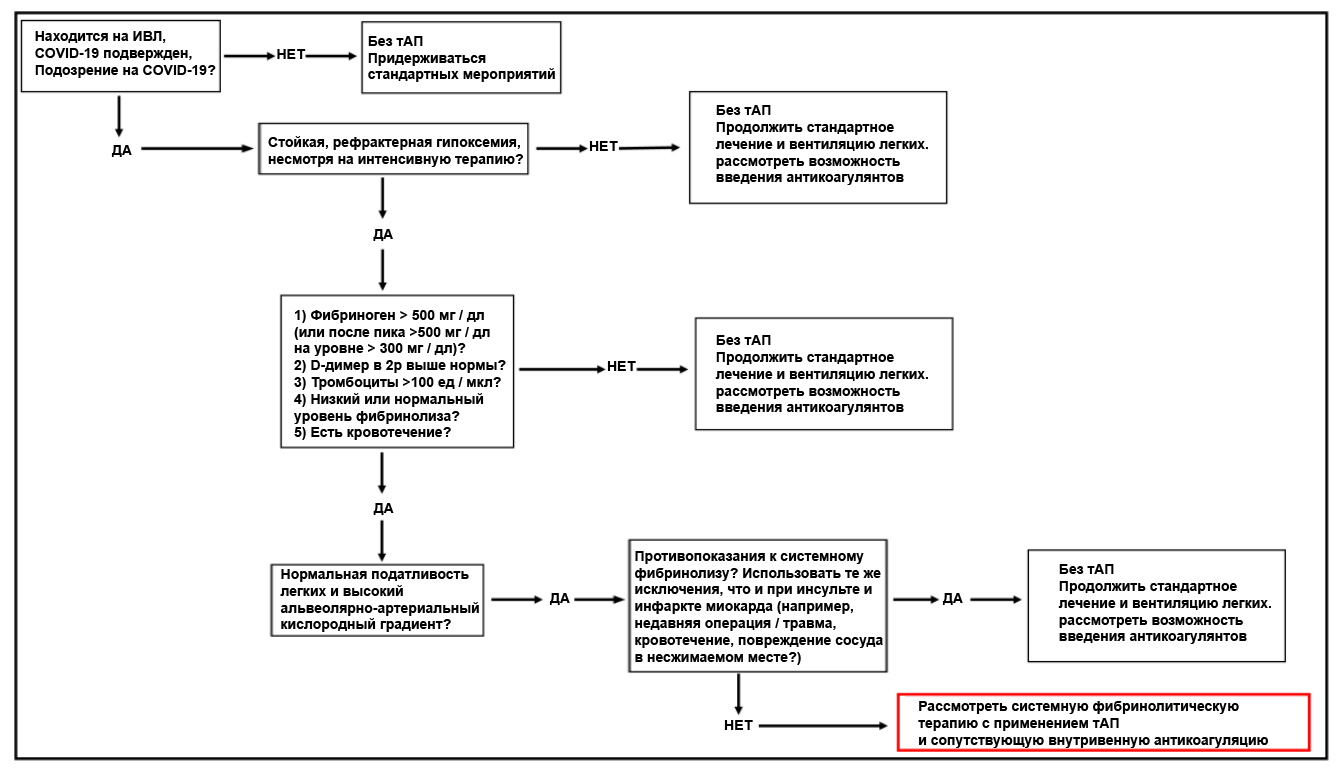
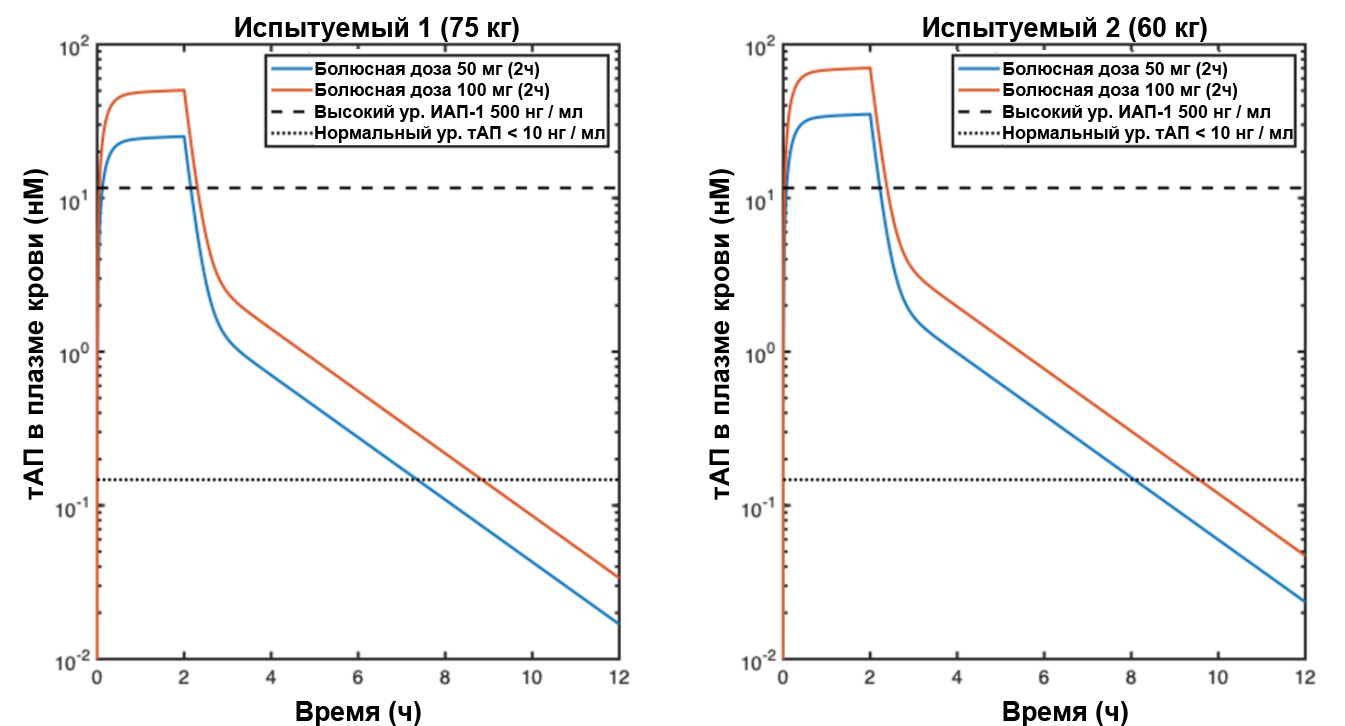
В случае, когда все доступные варианты лечения гипоксической дыхательной недостаточности, вызванной COVID-19, исчерпаны и клиническая картина наводит на мысль, что гипоксемия вызвана окклюзионной болезнью, стоит рассмотреть возможность проведения фибринолитической терапии. Важно отметить, что данный метод не прошел полного комплекса клинических испытаний, поэтому прибегать к нему следует с особой осторожностью, хотя на данный момент существуют некоторые свидетельства в пользу способности альтеплазы улучшить респираторный статус у пациентов с COVID-19 [49]. Положительный опыт от использования в/в тАП при инсульте, инфаркте миокарда и легочной тромбэмболии может лечь в основу протоколов экстренной помощи в тяжелейших случаях дыхательной недостаточности, вызванной COVID-19 [37], [50], [51]. В такой ситуации следует начать с болюсного в/в введения 50 или 100 мг альтерплазы в течение 2 часов с последующей немедленной антикоагуляцией гепарином. Во многих клиниках США уже применяют фибринолитическую терапию при тяжелой, рефрактерной гипоксемической дыхательной недостаточноти, ассоциированной с COVID-19. Однако, протокол введения гепарина варьируется: в/в гепарин (активированной частичное тромбопластиновое время, АЧТВ 60 – 80 сек) параллельно введению тАП; 500 ЕД/ч гепарина во время введения тАП; или наоборот, сперва тАП, а сразу после – гепарин. Для обоснования приведенных выше дозировок тАП было выполнено фармакологическое моделирование на двух «испытуемых» (75 и 60 кг). Обнаружено, что у пациентов с травмами болюсные дозы 50 и 100 мг быстро достигли концентрации тАП в плазме выше среднего уровня ПА-1 (200 нг / мл; 4,7 нМ) [52] (рис. 1). Такая фармакологическая модель допускает возможность повторного введения через 12 часов или позже, например, в случаях ретромбоза из-за неадекватной антикоагуляции [49], поскольку к этому времени уровни тАП после первого болюса падают ниже базового уровня [53]. Несомненно, для окончательных выводов требуется II фаза клинических испытаний. Представляется, что в/в доставка препарата – наиболее подходящий путь введения при COVID-19-ассоциированной дыхательной недостаточности; но в случае доставки препарата в дыхательные пути, дозировка должна составить 50 мг (или 0,7 мг/кг тАП, вводимого в дыхательные пути при бронхоскопии; повторные введения каждые 4 – 8 часов по мере необходимости). Данный протокол основан на эмпирических данных по лечению пациентов с пластическим бронхитом в детской больнице Колорадо, но имеются также многочисленные эксперименты на животных моделях [34], [54]–[56]. Следует применять те же критерии исключения, что и при инфаркте миокарда, где пациентам вводится гепарин для предотвращения повторного возникновения фибринового сгустка в микроциркуляторном русле легких. Алгоритм применимости фибринолитической терапии при тяжелой рефрактерной дыхательной недостаточности, вызванной COVID-19 отражен на рис. 2. Однако в связи с тем, что результатов клинических испытаний по этому методу все еще недостаточно, обращаться к нему следует лишь в случае тяжелой рефрактерной гипоксемической дыхательной недостаточности с признаками гиперкоагуляции, нормальной податливостью легких и высоким альвеолярно-артериальным кислородным градиентом, свидетельствующими об окклюзионном тромбозе. Несмотря на то, что состояние гиперкоагуляции в сочетании с перечисленными признаками встречается у большинства пациентов с вызванной COVID-19 дыхательной недостаточностью, а тромбоз микрососудов выявляется в большинстве аутопсий, вероятность макрососудистой тромбэмболии также достаточно велика [44], [57], но может быть снижена благодаря фибринолитической терапии. Как обсуждалось ранее, этот подход сопряжен с определенными рисками, и прибегать к нему следует только тогда, когда все остальные варианты исчерпаны.
(рис 1)
Возможные риски, сопряженные с фибринолитической терапией
Главным риском фибринолитической терапии, направленной на лечение тяжелой рефрактерной гипоксемии, вызванной COVID-19, является кровотечение. Возможность возникновения кровотечения можно оценить на примере инфаркта миокарда (ИМ) и субмассивной тромбоэмболии легких. В самом обширном из доступных проспективных исследований было показано, что при внутривенном (в/в) введении альтеплазы, риск геморрагического инсульта составил 0,7%; а тяжелого / угрожающего жизни кровотечения – 0,4%. В этой группе 50 мг альтеплазы вводилось в течение 90 минут, с последующим в/в введением 5,000 ЕД болюсом нефракционированного гепарина и терапевтического капельного гепарина [33]. При введении высокой дозы альтеплазы (100 мг в течение 2 часов) в сочетании с гепарином при лечении субмассивной тромбоэмболии риск сильного кровотечения составил 0,8%, но ни у одного пациента из 118 человек этой группы не случилось геморрагического инсульта [37]. Предполагается, что эти две группы относительно схожи с тяжелым протеканием COVID-19 в связи осложнениями и отсутствием активного инсульта, который повышает риск геморрагической трансформации. Существует множество исследований, которые ссылаются высокий риск «сильного кровотечения», но большинство из них указывает на один мета-анализ, выполненный Chatterjee и колл. [38], где риск кровотечения при использовании альтеплазы (тАП) в лечении тромбоэмболии легких составил 9,24% по сравнению с 3,42% у группы, где использовались только антикоагулянты. Большинство пациентов из данного мета-анализа относились к одному исследованию (PEITHO), в котором использовалась тенектеплаза [39], устойчивая к воздействию со стороны ИАП-1 [40]. Кроме того, многие из включенных в мета-анализ исследований не имели единых критериев интенсивности кровотечения, в некоторых из них любое переливание крови относили к серьезному кровотечению, и, наконец, ни в одном из них не использовались в качестве критериев гемодинамические параметры или активация массивного трансфузионного протокола. Что касается пациентов с COVID-19, находящихся на ИВЛ, где вероятность смерти приблизительно равна вероятности выживания, угрожающие жизни кровоизлияния как раз подходят для оценки рисков фибринолитической терапии при тяжелой рефрактерной гипоксемии, вызванной COVID-19[33]. Кроме того, тяжелое течение COVID-19 скорее сопряжено с выраженной гиперкоагуляцией / тромботической коагулопатией, где выше вероятность тромбоза, а риски, сопряженные с фибринолизисной терапией, ниже [35], [41–44]. Несмотря на то, что в/в доставка тАП представляется более эффективной, не имеется данных о случаях кровотечений после введения тАП в дыхательные пути [34], [45].
Помимо возможности кровотечения, существует также риск увеличения вирусной нагрузки. Проникновение COVID-19 в клетку требует расщепления тримерного гликопротеина «шипа» (S), который выступает из вирусной оболочки с образованием двух субъединиц (S1 и S2) с последующим расщеплением внутри S2 [46]. Субъединица S1 является рецептор-связывающим доменом, который взаимодействует с АПФ2 на клеточной поверхности [32], [47]. Затем субъединица S2 запускает слияние вируса с мембраной клетки, которая приводит к проникновению вируса внутрь. Расщепление S белка на стыке S1 и S2 осуществляется благодаря протеазам хозяина, таким как TMPRSS2, по определенным серин-аргининовым последовательностям [46]. Плазмин, также как и TMPRSS2, способствует расщеплению аргинин-сериновым последовательностям [48], таким образом, введение тАП с образованием плазмина, предположительно, может повысить вирусную инфекционность. Однако, пациенты с терминальной стадией COVID-19, вероятнее всего, уже массивно инфицированы, и непосредственную угрозу жизни уже представляет выраженная гипоксическая дыхательная недостаточность, вызванная тромбозом микрососудов легких, а не сам вирус. В связи с этим предполагается, что эффекты активации плазмина, такие как повышение способности проникновения вируса или снижение его клиренса будут незначительными недостатками по сравнению с восстановлением микроциркуляции, предотвращением тяжелой гипоксической дыхательной недостаточности и спасением от неизбежной смерти.
Заключение
В период пандемии COVID-19, существующей уже несколько месяцев, врачи интенсивной терапии нередко сталкиваются с тяжелой рефрактерной гипоксемической дыхательной недостаточностью, связанной с микрососудистым тромбозом. Рандомизированные контролируемые испытания показали, что такое состояние проходит через месяцы, а то и годы. В связи с чем, в случае критических состояний пациентов с COVID-19, врачи опираются лишь на клиническое обоснование лечения, поскольку «золотые стандарты» терапии все еще не выработаны. Фибринолитическая терапия потенциально может принести больше пользы, чем вреда, в ситуациях, когда другие методы лечения исчерпали себя. Альтеплаза (тАП) имеется в большинстве медицинских учреждений, что открывает возможность широкого применения данного метода. Однако, в отсутствие результатов II фазы клинических испытаний, следует воздержаться от широкого внедрения и систематического использования фибринолитической терапии. Алгоритм применимости этого метода отражен на рис. 2.
(рис 2)
СПИСОК ЛИТЕРАТУРЫ
[1] M. HB et al., “Hyperfibrinolysis, Physiologic Fibrinolysis, and Fibrinolysis Shutdown: The Spectrum of Postinjury Fibrinolysis and Relevance to Antifibrinolytic Therapy,” J. Trauma Acute Care Surg., vol. 77, no. 6, 2014, doi: 10.1097/TA.0000000000000341.
[2] M. HB et al., “Fibrinolysis Shutdown Is Associated With a Fivefold Increase in Mortality in Trauma Patients Lacking Hypersensitivity to Tissue Plasminogen Activator,” J. Trauma Acute Care Surg., vol. 83, no. 6, 2017, doi: 10.1097/TA.0000000000001718.
[3] M. HB et al., “Acute Fibrinolysis Shutdown After Injury Occurs Frequently and Increases Mortality: A Multicenter Evaluation of 2,540 Severely Injured Patients,” J. Am. Coll. Surg., vol. 222, no. 4, 2016, doi: 10.1016/J.JAMCOLLSURG.2016.01.006.
[4] M. HB, W. M, K. HC, and M. RL, “The Complexity of Trauma-Induced Coagulopathy,” Semin. Thromb. Hemost., vol. 46, no. 2, 2020, doi: 10.1055/S-0040-1702202.
[5] H. B. Moore and E. E. Moore, “Temporal Changes in Fibrinolysis following Injury.,” Semin. Thromb. Hemost., vol. 46, no. 2, pp. 189–198, Mar. 2020, doi: 10.1055/s-0039-1701016.
[6] P. M et al., “Hypercoagulability of COVID-19 Patients in Intensive Care Unit. A Report of Thromboelastography Findings and Other Parameters of Hemostasis,” J. Thromb. Haemost., 2020, doi: 10.1111/JTH.14850.
[7] H. JJ, H. JJ, J. NP, L. M, and S. MJ, “The Role of Bronchoalveolar Hemostasis in the Pathogenesis of Acute Lung Injury,” Semin. Thromb. Hemost., vol. 34, no. 5, 2008, doi: 10.1055/S-0028-1092878.
[8] S. Idell, “Coagulation, fibrinolysis, and fibrin deposition in acute lung injury.,” Crit. Care Med., vol. 31, no. 4 Suppl, pp. S213-20, Apr. 2003, doi: 10.1097/01.CCM.0000057846.21303.AB.
[9] S. Idell, K. B. Koenig, D. S. Fair, T. R. Martin, J. McLarty, and R. J. Maunder, “Serial abnormalities of fibrin turnover in evolving adult respiratory distress syndrome.,” Am. J. Physiol., vol. 261, no. 4 Pt 1, pp. L240-8, Oct. 1991, doi: 10.1152/ajplung.1991.261.4.L240.
[10] T. Fuchs-Buder et al., “Time course of procoagulant activity and D dimer in bronchoalveolar fluid of patients at risk for or with acute respiratory distress syndrome.,” Am. J. Respir. Crit. Care Med., vol. 153, no. 1, pp. 163–7, Jan. 1996, doi: 10.1164/ajrccm.153.1.8542111.
[11] A. F et al., “2019-novel Coronavirus Severe Adult Respiratory Distress Syndrome in Two Cases in Italy: An Uncommon Radiological Presentation,” Int. J. Infect. Dis., vol. 93, 2020, doi: 10.1016/J.IJID.2020.02.043.
[12] R. C. Bone, P. B. Francis, and A. K. Pierce, “Intravascular coagulation associated with the adult respiratory distress syndrome.,” Am. J. Med., vol. 61, no. 5, pp. 585–9, Nov. 1976, doi: 10.1016/0002-9343(76)90135-2.
[13] W. LB and M. MA, “The Acute Respiratory Distress Syndrome,” N. Engl. J. Med., vol. 342, no. 18, 2000, doi: 10.1056/NEJM200005043421806.
[14] W. LB, “Pathophysiology of Acute Lung Injury and the Acute Respiratory Distress Syndrome,” Semin. Respir. Crit. Care Med., vol. 27, no. 4, 2006, doi: 10.1055/S-2006-948288.
[15] S. E. Fox, A. Akmatbekov, J. L. Harbert, G. Li, J. Q. Brown, and R. S. Vander Heide, “Pulmonary and Cardiac Pathology in Covid-19: The First Autopsy Series from New Orleans,” medRxiv, p. 2020.04.06.20050575, Apr. 2020, doi: 10.1101/2020.04.06.20050575.
[16] W. Luo et al., “Clinical Pathology of Critical Patient with Novel Coronavirus Pneumonia (COVID-19).” Preprints, Feb. 27, 2020, Accessed: May 14, 2020. [Online]. Available: https://www.preprints.org/manuscript/202002.0407/v1.
[17] S. Tian, W. Hu, L. Niu, H. Liu, H. Xu, and S.-Y. Xiao, “Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer,” J. Thorac. Oncol., vol. 15, no. 5, pp. 700–704, May 2020, doi: 10.1016/J.JTHO.2020.02.010.
[18] J. A. Bastarache et al., “The alveolar epithelium can initiate the extrinsic coagulation cascade through expression of tissue factor.,” Thorax, vol. 62, no. 7, pp. 608–16, Jul. 2007, doi: 10.1136/thx.2006.063305.
[19] X. Yang et al., “Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study,” Lancet Respir. Med., vol. 8, no. 5, pp. 475–481, May 2020, doi: 10.1016/S2213-2600(20)30079-5.
[20] H. H et al., “Prominent Changes in Blood Coagulation of Patients With SARS-CoV-2 Infection,” Clin. Chem. Lab. Med., 2020, doi: 10.1515/CCLM-2020-0188.
[21] C. Wu et al., “Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China,” JAMA Intern. Med., Mar. 2020, doi: 10.1001/jamainternmed.2020.0994.
[22] N. Tang, D. Li, X. Wang, and Z. Sun, “Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia,” J. Thromb. Haemost., vol. 18, no. 4, pp. 844–847, Apr. 2020, doi: 10.1111/jth.14768.
[23] J. Thachil et al., “ISTH interim guidance on recognition and management of coagulopathy in COVID‐19,” J. Thromb. Haemost., vol. 18, no. 5, pp. 1023–1026, May 2020, doi: 10.1111/jth.14810.
[24] O. SR et al., “Discrepant Fibrinolytic Response in Plasma and Whole Blood During Experimental Endotoxemia in Healthy Volunteers,” PLoS One, vol. 8, no. 3, 2013, doi: 10.1371/JOURNAL.PONE.0059368.
[25] M. Schouten, W. J. Wiersinga, M. Levi, and T. van der Poll, “Inflammation, endothelium, and coagulation in sepsis,” J. Leukoc. Biol., vol. 83, no. 3, pp. 536–545, Mar. 2008, doi: 10.1189/JLB.0607373.
[26] B. JA, W. LB, and B. GR, “The Role of the Coagulation Cascade in the Continuum of Sepsis and Acute Lung Injury and Acute Respiratory Distress Syndrome,” Semin. Respir. Crit. Care Med., vol. 27, no. 4, 2006, doi: 10.1055/S-2006-948290.
[27] F. H. (Franklin H. Martin et al., Surgery, gynecology & obstetrics. [Franklin H. Martin Memorial Foundation, etc.], 2016.
[28] Z. Varga et al., “Endothelial cell infection and endotheliitis in COVID-19,” Lancet, vol. 395, no. 10234, pp. 1417–1418, May 2020, doi: 10.1016/S0140-6736(20)30937-5.
[29] H. I, T. W, B. ML, L. AT, N. G, and van G. H, “Tissue Distribution of ACE2 Protein, the Functional Receptor for SARS Coronavirus. A First Step in Understanding SARS Pathogenesis,” J. Pathol., vol. 203, no. 2, 2004, doi: 10.1002/PATH.1570.
[30] H. RM, H. H, T. AH, W. CH, V. Y, and K. GF, “Treatment of severe acute respiratory distress syndrome: a final report on a phase I study.,” Am. Surg., vol. 67, no. 4, pp. 377–382, Apr. 2001, Accessed: May 14, 2020. [Online]. Available: https://europepmc.org/article/med/11308009.
[31] C. Liu et al., “Meta-Analysis of Preclinical Studies of Fibrinolytic Therapy for Acute Lung Injury.,” Front. Immunol., vol. 9, p. 1898, 2018, doi: 10.3389/fimmu.2018.01898.
[32] Y. R, Z. Y, L. Y, X. L, G. Y, and Z. Q, “Structural Basis for the Recognition of SARS-CoV-2 by Full-Length Human ACE2,” Science, vol. 367, no. 6485, 2020, doi: 10.1126/SCIENCE.ABB2762.
[33] GUSTO investigators, “An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction.,” N. Engl. J. Med., vol. 329, no. 10, pp. 673–82, 1993, doi: 10.1056/NEJM199309023291001.
[34] E. Gibb et al., “Management of plastic bronchitis with topical tissue-type plasminogen activator.,” Pediatrics, vol. 130, no. 2, pp. e446-50, Aug. 2012, doi: 10.1542/peds.2011-2883.
[35] H. H et al., “Prominent Changes in Blood Coagulation of Patients With SARS-CoV-2 Infection,” Clin. Chem. Lab. Med., 2020, doi: 10.1515/CCLM-2020-0188.
[36] H. L et al., “Prospective, Longitudinal Study of Plastic Bronchitis Cast Pathology and Responsiveness to Tissue Plasminogen Activator,” Pediatr. Cardiol., vol. 32, no. 8, 2011, doi: 10.1007/S00246-011-0058-X.
[37] S. Konstantinides, A. Geibel, G. Heusel, F. Heinrich, W. Kasper, and Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators, “Heparin plus alteplase compared with heparin alone in patients with submassive pulmonary embolism.,” N. Engl. J. Med., vol. 347, no. 15, pp. 1143–50, Oct. 2002, doi: 10.1056/NEJMoa021274.
[38] S. Chatterjee et al., “Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis.,” JAMA, vol. 311, no. 23, pp. 2414–21, Jun. 2014, doi: 10.1001/jama.2014.5990.
[39] G. Meyer et al., “Fibrinolysis for patients with intermediate-risk pulmonary embolism.,” N. Engl. J. Med., vol. 370, no. 15, pp. 1402–11, Apr. 2014, doi: 10.1056/NEJMoa1302097.
[40] D. F et al., “A Novel Variant of t-PA Resistant to Plasminogen Activator inhibitor-1; Expression in CHO Cells Based on in Silico Experiments,” BMB Rep., vol. 44, no. 1, 2011, doi: 10.5483/BMBREP.2011.44.1.34.
[41] M. Panigada et al., “Hypercoagulability of COVID-19 patients in Intensive Care Unit. A Report of Thromboelastography Findings and other Parameters of Hemostasis.,” J. Thromb. Haemost., Apr. 2020, doi: 10.1111/jth.14850.
[42] C. D. Barrett, H. B. Moore, M. B. Yaffe, and E. E. Moore, “ISTH interim guidance on recognition and management of coagulopathy in COVID-19: A Comment.,” J. Thromb. Haemost., Apr. 2020, doi: 10.1111/jth.14860.
[43] J. Thachil et al., “ISTH interim guidance on recognition and management of coagulopathy in COVID-19.,” J. Thromb. Haemost., vol. 18, no. 5, pp. 1023–1026, 2020, doi: 10.1111/jth.14810.
[44] K. FA et al., “Incidence of Thrombotic Complications in Critically Ill ICU Patients With COVID-19,” Thromb. Res., 2020, doi: 10.1016/J.THROMRES.2020.04.013.
[45] H. L et al., “Prospective, Longitudinal Study of Plastic Bronchitis Cast Pathology and Responsiveness to Tissue Plasminogen Activator,” Pediatr. Cardiol., vol. 32, no. 8, 2011, doi: 10.1007/S00246-011-0058-X.
[46] H. M et al., “SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor,” Cell, vol. 181, no. 2, 2020, doi: 10.1016/J.CELL.2020.02.052.
[47] D. Wrapp et al., “Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation.,” Science, vol. 367, no. 6483, pp. 1260–1263, 2020, doi: 10.1126/science.abb2507.
[48] L. S. Hervio, G. S. Coombs, R. C. Bergstrom, K. Trivedi, D. R. Corey, and E. L. Madison, “Negative selectivity and the evolution of protease cascades: the specificity of plasmin for peptide and protein substrates.,” Chem. Biol., vol. 7, no. 6, pp. 443–53, Jun. 2000, doi: 10.1016/s1074-5521(00)00125-3.
[49] W. J et al., “Tissue Plasminogen Activator (tPA) Treatment for COVID-19 Associated Acute Respiratory Distress Syndrome (ARDS): A Case Series,” J. Thromb. Haemost., 2020, doi: 10.1111/JTH.14828.
[50] C. Kaufman, T. Kinney, and K. Quencer, “Practice Trends of Fibrinogen Monitoring in Thrombolysis,” J. Clin. Med., vol. 7, no. 5, 2018, doi: 10.3390/JCM7050111.
[51] J. M. Wardlaw, V. Murray, E. Berge, G. J. del Zoppo, and C. S. Group, “Thrombolysis for acute ischaemic stroke,” Cochrane Database Syst. Rev., vol. 2014, no. 7, 2014, doi: 10.1002/14651858.CD000213.PUB3.
[52] C. JC, M. N, B. LA, H. JB, C. BA, and W. CE, “Elevated Tissue Plasminogen Activator and Reduced Plasminogen Activator Inhibitor Promote Hyperfibrinolysis in Trauma Patients,” Shock, vol. 41, no. 6, 2014, doi: 10.1097/SHK.0000000000000161.
[53] C. LONGSTAFF, P. RIGSBY, and C. WHITTON, “Calibration of the WHO 1st International Standard and SSC/ISTH Secondary Coagulation Standard for Tissue Plasminogen Activator Antigen in Plasma,” J. Thromb. Haemost., vol. 8, no. 8, pp. 1855–1857, Aug. 2010, doi: 10.1111/j.1538-7836.2010.03934.x.
[54] T. B. Do, J. M. Chu, F. Berdjis, and N. G. Anas, “Fontan patient with plastic bronchitis treated successfully using aerosolized tissue plasminogen activator: a case report and review of the literature.,” Pediatr. Cardiol., vol. 30, no. 3, pp. 352–5, Apr. 2009, doi: 10.1007/s00246-008-9312-2.
[55] M. Colaneri, A. Quarti, M. Pozzi, S. Gasparini, I. Carloni, and F. M. de Benedictis, “Management of plastic bronchitis with nebulized tissue plasminogen activator: another brick in the wall.,” Ital. J. Pediatr., vol. 40, no. 1, p. 18, Feb. 2014, doi: 10.1186/1824-7288-40-18.
[56] V. LA et al., “Airway Tissue Plasminogen Activator Prevents Acute Mortality Due to Lethal Sulfur Mustard Inhalation,” Toxicol. Sci., vol. 143, no. 1, 2015, doi: 10.1093/TOXSCI/KFU225.
[57] R. DC, B.-A. C, von G. C, and Q. SD, “Pulmonary Embolism in Patients With COVID-19: Time to Change the Paradigm of Computed Tomography,” Thromb. Res., vol. 190, 2020, doi: 10.1016/J.THROMRES.2020.04.011.